Айгуль Жилкишина
В центре фармацевтической биотехнологии университета штата Иллинойс в Чикаго впервые создана синтетическая рибосома, работающая в живой клетке. Долгое время считалось, что это за пределами наших познаний и технологических возможностей, но сегодня она стала новой страницей в истории развития биотехнологий. Ученые получили такую структуру, которая способна синтезировать белки “по заказу” исследователей. Результаты работы ученых создали основу для разработки новых лекарств и биоматериалов следующего поколения, то есть потенциального лекарства от рака, вирусов и бактерий
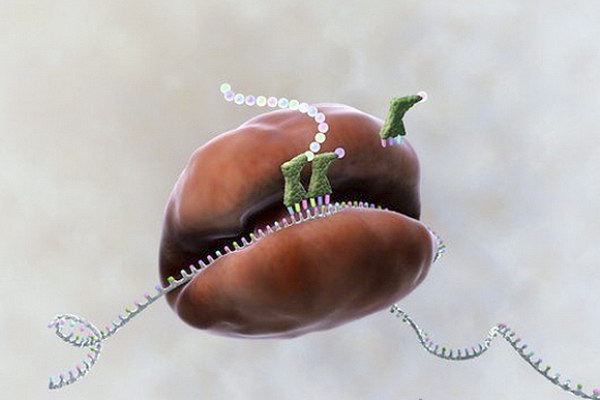
Основными “кирпичами” наших клеток являются рибосомы. В них из аминокислот образуется необходимый для жизни белок. Этот процесс называется трансляцией. Рибосомы состоят из двух частей: малой и большой, которые вообще-то существуют в клетке параллельно и объединяются в одно целое, лишь когда необходимо образовать молекулу белка для растущей белковой цепи. Когда трансляция заканчивается, они вновь разделяются.
Так вот, группа исследователей под руководством Александра Манькина (Иллинойский университет в Чикаго) и Майкла Джуветта (Северо-Западный университет) создала искусственную рибосому, которая выполняет те же функции, что и естественная. С тем, однако, принципиальным отличием, что ее части не отделяются друг от друга после образования белка. В ходе работы ученые изменили структуру рибосомы, “запретив” ее субчастицам разделяться после того, как синтез белка закончится.
Вообще-то синтез белков - давняя затея ученых. И вот уже три десятка лет - не просто мечта, а реальность.
Однако получаемые до сегодняшнего дня искусственные белки были полной копией естественных. А в новых рибосомах (так называемых Ribo-T) теоретически можно запускать биосинтез 172 аминокислот (вместо существующих в природе 20) и создавать в промышленных масштабах абсолютно другие белки.
“В своей работе авторы преодолели основное препятствие для создания полностью синтетических рибосом с заданными свойствами, - отмечает научный сотрудник Лос-Аламосской национальной лаборатории Карисса Санбонмацу, - они заложили основу для драматических изменений”.
Переиначив природный “завод по производству белка” - результат трех-пяти миллиардов лет эволюции живой материи, ученые совершили настоящую научную революцию. Дело в том, что искусственные рибосомы могут быть настроены таким образом, чтобы синтезировать конкретные виды протеинов, на которые рибосомы не запрограммированы в природе. Такие способности “нового” белка открывают уникальные возможности для фармакологии - создание лекарственных препаратов с заданными характеристиками, антибиотиков, блокирующих работу бактериальных клеток.
Пока каждая Ribo-T способна синтезировать только протеины определенного класса, но в будущем биотехнологи добьются создания универсальной синтетической рибосомы, способной выполнять “сборку” любых белков на заказ. Это могут быть компоненты с любой биологической активностью - не содержащие возбудителя безопасные вакцины, гормоны, компоненты селективных лекарств, новых косметических средств и пищевых продуктов.
Кроме того, Ribo-T можно научить включать неприродные аминокислоты в белок для того, чтобы сделать его лучше, более “полезным” или вообще другим. Такие терапевтические белки будут более устойчивы в клетках, а значит, их не надо будет давать пациентам слишком часто. Такие Ribo-T можно сделать лучше, подшивая к ним всевозможные “боеголовки” для атак на наших врагов - патогенные бактерии и вирусы, раковые клетки. И они смогут пресечь безудержное размножение “неправильных”, в том числе и раковых клеток.
Даулет Байпеисов, заместитель директора по стратегическому развитию Казахского НИИ онкологии и радиологии, полагает, что медицина XXI века стоит на пороге больших изменений. “Онкология завтрашнего дня - это персонифицированная терапия, основанная на индивидуальном подходе. Расшифровка генетического кода человека способствовала развитию нового направления - фармакогенетики. При назначении схемы лечения помимо стадии злокачественного новообразования, пола, возраста и состояния учитываются индивидуальные генетические особенности раковой опухоли или пациента, определяемые методом молекулярного профилирования. Мы считаем это большим шагом в борьбе с коварным недугом.
Казахстанские онкологи так же, как и зарубежные врачи, внимательно следят за результатами фундаментальных и прикладных научных исследований, которые могут внести кардинальные изменения в профилактику, диагностику и лечение онкологических заболеваний. Онкологи Казахстана внедряют инновационные методы диагностики злокачественных новообразований, к примеру, практически во всех онкологических диспансерах внедрен иммуногистохимический метод исследования, позволяющий осуществлять подбор химиопрепаратов с учетом индивидуальной чувствительности каждого онкологического пациента”. |